例析電池串聯(lián)裝置中電池類型的判斷
◇ 廣西 馬德信
電化學原理是高考必考知識點,主要考查原電池和電解池的工作原理和電極反應式,有時也將原電池和電解池結(jié)合在一起,綜合考查電池正負極、陰陽極的判斷,電子或離子的移動方向,電極反應式的書寫和化學計算等知識,是高考試卷中的重要題型.解答試題的關鍵是判斷電池種類.
1 根據(jù)電化學裝置判斷
例1如圖1是一個化學過程的示意圖.已知甲池的總反應式為2CH3OH+3 O2+4 KOH=2 K2CO3+6 H2O,請回答:
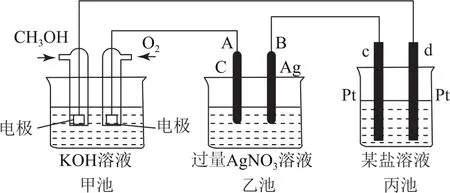
圖1
(1)甲池是________池,通入O2的電極作為________極,電極反應式為________.
(2)乙池是________池,A電極名稱為________極,電極反應式為________.乙池中的總反應離子方程式為________,溶液的p H________(填“增大”“減小”或“不變”).
(3)當乙池中B極(Ag)的質(zhì)量增加5.40 g時,甲池中理論上消耗O2_______mL(標準狀況下).
分析(1)甲裝置自發(fā)地發(fā)生反應:2CH3OH+3 O2+4 KOH=2 K2CO3+6 H2O,為原電池,通入氧氣的一極為原電池的正極,電極方程式為O2+2 H2O+4e-=4 OH-.
(2)乙池為電解池,A與原電池正極相連,為電解池的陽極,發(fā)生氧化反應,電極方程式為4 OH--4e-=O2↑+2 H2O,電解硝酸銀溶液,陽極生成氧氣,陰極生成銀,電解總反應式為4 Ag+O2↑+4 H+,則溶液p H減小.
(3)乙池中B極電極方程式為Ag++e-=Ag,則轉(zhuǎn)移電子0.05 mol,由電極方程式O2+2 H2O+4e-=4 OH-可知消耗O20.012 5 mol,則標準狀況下V(O2)=280 mL.
2 根據(jù)電池中的電極材料和電解質(zhì)溶液判斷
例2某課外小組同學按圖2裝置進行實驗,回答下列問題:
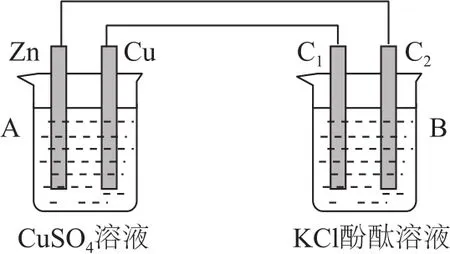
圖2
(1)根據(jù)電極材料和電解質(zhì)溶液,判斷A池為________,B池為________.
(2)Zn電極為________極,Cu電極反應式為________,C1為________極,電極反應式為________,C2附近發(fā)生的現(xiàn)象為________.
(3)開始時Zn電極和Cu電極質(zhì)量相等,當C2極析出標準狀態(tài)下224 mL氣體,Cu電極和Zn電極質(zhì)量差為________g.
分析(1)A電池中的兩個電極不同,且鋅能和硫酸銅發(fā)生置換反應,構成原電池;B電池中兩個電極都是碳棒,相當于外加電源,是電解池.
(2)鋅比銅活潑,鋅是負極,銅是正極,發(fā)生還原反應,電極反應式是Cu2++2e-=Cu.C1與電源的正極相連,是電解池的陽極,電極反應式為2Cl--2e-=Cl2↑;電極C2和電源的負極相連作陰極,電極反應式為2 H2O+2e-=H2↑+2 OH-,破壞溶液中水的電離平衡,使C2電極周圍溶液顯堿性,實驗現(xiàn)象為碳棒上產(chǎn)生氣泡且附近溶液變紅.
(3)標準狀況下224 mL氣體是氫氣,物質(zhì)的量是0.01 mol,則轉(zhuǎn)移0.02 mol電子,消耗鋅的物質(zhì)的量是0.01 mol,質(zhì)量是0.65 g,正極析出銅的質(zhì)量是0.64 g.設開始時Zn電極和Cu電極質(zhì)量都為mg,實驗后Cu電極和Zn電極質(zhì)量差為
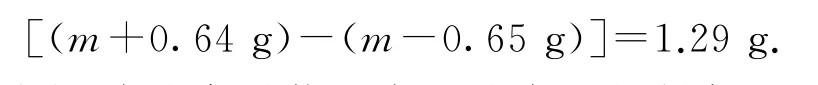
總之,多池串聯(lián)裝置中電池類型的判斷,可根據(jù)裝置直接判斷,也可以根據(jù)構成電池的條件判斷,還可以根據(jù)實驗過程中的電極反應現(xiàn)象判斷.

